Ecuación Fundamental de la Calorimetría
Consideremos un cuerpo de masa m a la temperatura inicial ti.
Suministrándole una cantidad de calor Q a ese cuerpo, supongamos que su temperatura aumente hasta tf.
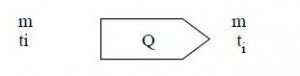
Q = mc (tf – ti) o Q = mcΔt
Donde:
c llamase calor específico de la substancia
Δt = tf – ti es la variación de la temperatura.
Observaciones:
1a.)
Si tf > tI , el cuerpo recibe calor, o sea, Q > 0.
Si tf < tI , el cuerpo emite calor, o sea, Q < 0.
2a.)
El producto mc es la capacidad térmica del cuerpo, luego: C = mc
Ejemplo:
Calcular la cantidad de calor necesaria para elevar una masa de 500 gramos de hierro de 15ºC para 85ºC. El calor específico del hierro es igual a 0,114 cal/g. ºC.
Resolución:
Se la masa del hierro sufre aumento de temperatura el calor es sensible, luego:
Q = mc (tf – ti) Þ Q = 500 . 0,114 (85º – 15º)
Q = 500 . 0,114 . 70
Q = 3990cal.
Respuesta:
La cantidad de calor recibida por el hierro es de 3990cal.
P.D.: La brisa marítima y la brisa terrestre se dan debido al calor especifico del agua y de la tierra. El agua posee uno de los mayores calores específicos, por eso no solamente demora más a aumentar su temperatura pero también demora más ceder calor. El aire queda más denso en las cercanías del mar pues este último tiene la temperatura más baja durante el día (en relación a la temperatura de la tierra), así surge la llamada brisa marítima. Durante la noche el proceso es al revés. Esa brisa también regula la temperatura de la Tierra.
Vemos a seguir el calor específico de algunas substancias:
|
Substancia |
Calor específico (cal/gºC |
| Mercurio | 0,033 |
| Aluminio | 0,217 |
| Cobre | 0,092 |
| Plomo | 0,030 |
| Plata | 0,056 |
| Hierro | 0,114 |
| Latón | 0,094 |
| Hielo | 0,550 |
| Agua | 1,000 |
| Aire | 0,240 |
Cambios de fase – Calor latente:
Aprendimos que cuando emitimos calor a un cuerpo, este aumentará su temperatura. Pero ese calor puede ser utilizado no solamente para aumentar la temperatura pero también para cambiar el estado físico del cuerpo. Ese calor es llamado calor latente.
El cambio de estado puede ser:
El calor latente del cambio de estado de una substancia es igual a la cantidad de calor que debemos dar o retirar de un gramo de dicha substancia para que ella cambie de estado.
Q = mL donde: L es el calor latente de la substancia.
La cantidad de calor latente L puede ser positiva o negativa conforme el cuerpo reciba o emita calor.
Propagación del calor: Para que calor sea transmitido, tendremos los siguientes procesos:
– Conducción: La conducción es un proceso de transmisión de calor que ocurre, por ejemplo, a través de una barra metálica.
En ese proceso, los átomos del metal que están en contacto con una fuente térmica reciben calor de esta fuente y aumentan su agitación térmica. Por eso, colisionan con los átomos vecinos, transmitiéndoles agitación térmica. Así, de partícula a partícula, la energía térmica fluye a lo largo de la barra, calentándola por completo.
Por lo tanto, conducción es el proceso de transmisión de calor de partícula a partícula.
Observación. Las partículas apenas aumentan la vibración. Ellas no se mueven por el cuerpo.
– Convección: La convección es un modo de transmisión de calor que ocurre en los fluidos, o sea, en líquidos o gases, pero, junto con el traslado de materia. Por ejemplo, el aire caliente es menos denso que el aire frio, así él tiende a subir por la presión. Ej.: Congelador es ubicado en la parte de arriba de la heladera.
– Radiación o Irradiación: Es una forma de transmisión de calor por a través de ondas electromagnéticas. Dos cuerpos con temperaturas distintas tienden al equilibrio térmico, aunque entre ellos no exista ningún medio material. Ej.: Sol calentando la Tierra (existe vacío entre ellos).
